waineУДК 634.8. 037
БИОТЕХНОЛОГИЧЕСКИЕ МЕТОДЫ ФОРМИРОВАНИЯ БАНКА ОЗДОРОВЛЕННЫХ РАСТЕНИЙ И СОХРАНЕНИЯ ГЕНОФОНДА ВИНОГРАДА IN VITRO
Н.П. Дорошенко, А.А.Соболев ГНУ Всероссийский НИИ виноградарства и виноделия им. Я.И. Потапенко,
г. Новочеркасск
Представлены основные направления исследований по биотехнологии во ВНИИВиВ им. Я.И. Потапенко, среди которых особое внимание уделено оздоровлению растений от хронических заболеваний и получению базового посадочного материала класса А для закладки базисных маточников и перевода виноградарства на сертифицированную основу.
Общие тенденции развития мировой экономики определяют роль биотехнологии как движущей силы научно-технического прогресса. В национальных программах ведущих стран мира биотехнология является одной из приоритетных отраслей, отражающей уровень социально-экономического состояния общества.
Использование биотехнологией потенциала живых организмов в интересах хозяйственной деятельности позволяет решать проблемы, связанные с недостатком продовольствия, истощением запасов природных энергоносителей, предотвращением загрязнения окружающей среды, сохранением биологического разнообразия, диагностикой и лечением особо опасных заболеваний и других проблем.
Второй международный конгресс, который состоялся в 2003 году в Москве [1], определил основные актуальные направления развития биотехнологии, среди которых отмечена важность биотехнологий для улучшения качества жизни и среды обитания, обеспечения полноценного питания населения. Последнее имеет непосредственное значение для виноградарства.
Исследования по биотехнологии начаты во ВНИИВиВ им. Я.И. Потапенко в 1983 году. В настоящее время они проводятся по следующим направлениям:
- оздоровление растений от вирусов, микоплазм, бактериального рака и клональное микроразмножение перспективных сортов винограда; - разработка приемов световой биотехнологии в культуре изолированных тканей и органов винограда;
- адаптация оздоровленных in vitro растений винограда к нестерильным условиям и закладка маточников безвирусного посадочного материала.
Также разрабатывается нетрадиционный способ селекции винограда на бессемянность, способы повышения и сохранения жизнеспособности пыльцы бессемянных сортов винограда; технология создания коллекций винограда in vitro.
Инновационные процессы питомниководства винограда, направленные на получение при помощи биотехнологии высококачественного посадочного материала, являются основой долговечности и рентабельности многолетних насаждений. В связи с этим этому направлению уделяется особое внимание.
Максимальная продуктивность растений винограда может быть достигнута при отсутствии заражения их наиболее опасными вирусами, фитоплазмами, грибными, бактериальными болезнями, нематодами и другими вредителями.
Как следует из обзора П. Абрашевой [2], вирусы, размножаясь в растительных клетках и используя их для своей репродукции, вызывают нарушения в обмене веществ хозяина, которые ведут к задержке роста побегов. Подавление роста и постепенное редуцирование надземной части зараженных вирусами виноградных растений до полной их гибели - наиболее общий симптом, на который указывают исследователи, работавшие и работающие в этой области. Нарушая ход физиологических процессов, вирусы, в конечном счете, оказывают влияние на количество и качество продукции. У столовых сортов снижение качества приводит к невозможности использовать их на потребление в свежем состоянии, а винные сорта дают нетипичные для сорта вина. Больные растения, помимо этого, сильно страдают от неблагоприятных условий внешней среды. Ослабленные кусты нередко преждевременно усыхают, вызывая раннюю изреженность виноградников.
Оздоровление растений осуществляется при помощи культуры апикальных меристем при относительном размере эксплантов 0,1-0,2 мм, так как установлено, что экспланты малых размеров являются лучшими для элиминации вирусов. Для повышения низкой регенерационной способности таких эксплантов разработана оригинальная технология микроклонального размножения, защищенная патентами. Она состоит из следующих последовательных этапов: изолирование эксплантов (центральные почки глазков) и получение асептической культуры in vitro, выделение верхушечной меристемы, индукция адвентивного побегообразования, укоренение побегов, получение пробирочных растений, высадка растений-регенерантов в почвенный субстрат.
Ключевым моментом технологии является регенерация целого нормального жизнеспособного растения. Успех культивирования in vitro и получение нормальных растений непосредственно связано с оптимизаций условий на каждом этапе технологии. Как правило, даже небольшие отклонения от оптимума приводят к резкому снижению скорости роста и размножения, а также к ухудшению физиологического состояния регенерантов.
С целью оптимизации процесса оздоровления растений уточнено содержание цигокинина 6-БАП на этапе ввода, разработан способ повышения регенерационной способности меристем воздействием на них электромагнитным облучением низкой интенсивности (СВЧ-лучи) в комплексе с узкополосным лазером [3], доказана перспективность применения нового фиторегулятора эмистим [4].
Способ комбинированной обработки меристем электромагнитным полем (ЭМИ) сверхвысокой частоты (СВЧ-лучи) и узкополосным лазером основан на модификации и изменении проницаемости клеточных мембран под действием лучей СВЧ, что приводит к усилению притока питательных веществ, воды и кислорода и активизирует ферментные системы обмена веществ (табл. 1).
Таблица 1
Регенерационнан способность меристем при различной продолжительности комплексного облучения 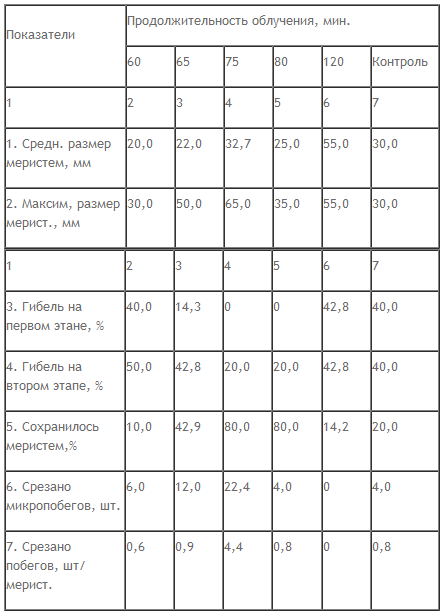
Как следует из приведенных данных, при облучении меристем в течение 75 минут возрастает средний и максимальный размер меристем, уменьшается их гибель от некроза, увеличивается число срезанных микропобегов в расчете на одну выделенную меристему с 0,8 в контроле до 4,4 шт., то есть регенерационная способность меристем возрастает в 5,5 раза.
Особое значение имеет применение препарата эмистим на этапе ввода меристем в культуру ткани. Меристемы размером 0,1 -0,2 мм, выделенные и высаженные на питательную среду, нуждаются в защите от стресса и патогенов, в стимуляции клеточного деления для их роста и усиления пролиферации (новообразование узлов и побегов) на следующем этапе собственно микроразмножения. Поэтому эмистим оказывает положительное влияние на улучшение регенерационной способности: улучшается как приживаемость, так и продуктивная регенерация меристем.
Оптимизации клонального микроразмножения на этапе микрочеренкования пробирочных растений способствует применение СВЧ- лучей [5], растительной добавки из тонкоразмолотых семян винограда [6], введение в питательную среду 6-БАП [7]. Под воздействием СВЧ- лучей увеличивается суточная скорость роста в 1,7-2,4 раза, масса растений в 2 раза, длина побега в 1,7 раза, число образовавшихся узлов в 1,2-1,5 раза. При добавлении в питательную среду естественных стимуляторов роста из семян винограда эффективность клонального микроразмножения увеличивается на 27,4 % (табл. 2).
Влияние естественных стимуляторов из семян винограда на показатели развития растений на этапе микрочеренкования 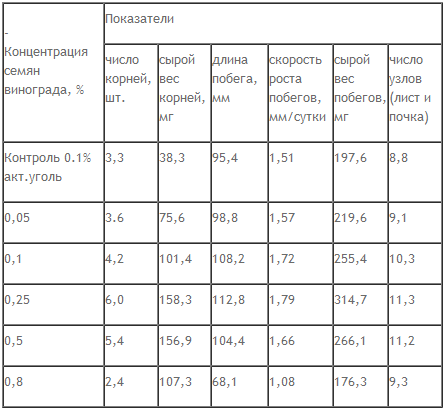
Таблица 3В процессе проведения исследований разработаны и усовершенствованы способы, направленные на улучшение регенерации растений, такие как: стерилизация исходных эксплантов, борьба с хронической инфекцией, оптимизация питательных сред, оптимизация клонального микроразмножения на этапах пролиферации и микрочеренкования, адаптация растений к нестерильным условиям.
Разработан метод водной терапии вызревших микрочеренков с последующей культурой апикальных меристем для комплексного оздоровления растений от вирусов, вирусоподобных заболеваний и микоплазм (табл. 3).
Уточнены режимы обработки, обеспечивающие приживаемость, продуктивную регенерацию и оздоровление для целого ряда сортов винограда: Степняк, Саперави северный, Цветочный, Фиолетовый ранний, Душистый, Московский устойчивый. После проведения водной терапии у всех изученных сортов сохраняются жизнеспособные меристемы. Однако при некоторых режимах обработки отсутствует как приживаемость меристем, так и их регенерация. Такими режимами являются: 45 °С, 10 минут; 50 °С, 10 минут; 55 °С, 45 минут; 55 °С, 60 минут; 55 °С, 75 минут. Они не пригодны для проведения водной терапии. Оптимальными режимами, обеспечивающими высокую репаративную и продуктивную регенерацию меристем, являются: температура воды 45 °С, экспозиция 45 минут и температура воды 55 °С, экспозиция 30 минут [8].
Регенерационная способность меристем при различных режимах водной терапии 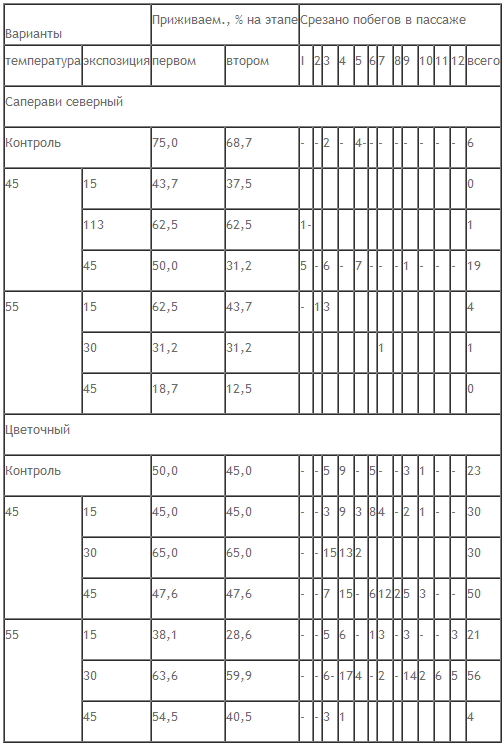
отбор исходного материала на виноградных кустах без признаков вирусных и бактериальных болезней;Результаты изучения фитогормона эмистим указывают на то, что этот препарат положительно влияет на рост меристематических тканей, процессы роста пробирочных растений, снижает влияние неблагоприятных и стрессовых факторов, повышает устойчивость к патогенам. Производственная проверка, проведенная на сорте Каберне северный, показала, что, благодаря эмистиму, улучшается адаптация пробирочных растений к нестерильным условиям до 95-100 %.
Таким образом, разработаны способы повышения регенерационной способности меристем и, следовательно, эффективности оздоровления растений винограда от вирусной инфекции, которая подтверждена тестированием на травянистых индикаторах и при помощи полимеоазной цепной реакции (ПЦР).
С целью повышения эффективности оздоровления и клонального микроразмножения винограда изучены минимальные параметры интенсивности и длительности освещения, необходимые для развития качественных микроклонов, отзывчивость винограда in vitro на разнокачественное освещение [9].
Установлено, что на этапе ввода в культуру оптимальным для развития меристем оказалось освещение 1800-2000 лк. На этапе микрочеренкования побегов сортов Дружба, Цимлянский черный, Рихтер 110 качественные микроклоны у этих сортов развивались при освещенности 2900-3200 лк, а у сорта Цветочный при 1600-1700 лк. Также установлено наличие адаптационной способности растений к слабой интенсивности освещения при их пересадке в нестерильные условия среды. Лучшей энергетической освещенностью для развития растений сорта Феркаль оказалась интенсивность 1700-1900 лк [10].
В результате изучения предложена замена традиционного длиннодневного фотопериода (16 часов) на более короткий (14 часов) для сортов Цимлянский черный и Феркаль. При структуре фотопериода 16-1 час наблюдалось наибольшее количество отбракованных растений. Продолжительность освещения в течение 12 часов может задерживать развитие микроклонов.
Для усиления роста побегов на этапах микрочеренкования и адаптации к нестерильным условиям возможно использование освещения низкой интенсивности с преобладанием лучей, максимум которых находится в оранжевой спектральной области (611 нм) Освещение эксплантов и адаптированных растений лучами синего спектрального состава (450 нм) оказывает на них влияние, близкое по качеству к естественному освещению.
Дтя повышения иммунитета и усиления ростовых процессов эффективно применение фиторегулятора роста эмистим в концентрациях 1012 и 10 10 % при интенсивности лучевого потока 2200-2400 лк. При освещении 1600-1700 лк для стимуляции ростовых процессов можно использовать маннит в концентрации 6 мг/л [11].
Разработан способ адаптации оздоровленных пробирочных растений винограда к нестерильным условиям среды, обеспечивающий высокий выход адаптированных растений [12], и способы посад- ки оздоровленных вегетирующих саженцев в пленочных, стационарных теплицах и в открытом грунте [13].
Оздоровленные сорта винограда накапливаются в коллекции и используются для закладки маточников. Ранее нами маточники закладывались в пленочных, стационарных теплицах и в открытом грунте в ОПХ ВНИИВиВ и в шести виноградарских хозяйствах Дона. В настоящее время начата работа по созданию центра предварительного размножения базисного посадочного материала класса А в Нижне-Кундрюченском отделении опытного поля ВНИИВиВ им. Я.И. Потапенко.
Идеальной альтернативой или дополнением к полевой коллекции является хранение винограда in vitro в виде растущих коллекций периодически субклонируемых растений. Для этого разработаны способы хранения при пониженной положительной температуре и освещенности, с применением ростовых и осмотических ингибиторов.
При добавлении в питательную среду сорбита продолжительность хранения составляет 4 месяца. Продолжительность культивирования без пересадок при пониженной положительной температуре и освещенности составляет 6 месяцев. Такой же результат получен при добавлении в питательную среду хлорхолинхлорида и 6-БАП на утроенном содержании сахарозы.
Впервые осуществлено применение природных ингибиторов для депонирования растений винограда [14]. Добавление в питательную среду семян в повышенных концентрациях (1,0% порошок тон- коразмолотых семян или 20 % вытяжка) создает в ней такой уровень естественных ингибиторов, при котором наблюдается снижение ростовых процессов и можно в 4-5 раз увеличить промежутки времени между пересадками растений на свежую питательную среду.
Предложены новые условия продолжительного хранения генофонда винограда: до 10-12 месяцев и более без пересадок за счет использования питательной среды Мурасиге и Скуга, модифицированной для хранения, температуры 4 °С и освещенности 0,3-0,5 тыс. люкс [15]. Выявлена возможность сохранения растений без пересадки в течение 210-240 дней, используя питательную среду для длительного хранения и понизив освещенность до 400-500 лк, не изменяя при этом параметры температурного режима [11].
Разработана технология создания генофонда винограда in vitro, которая включает:
- ввод в культуру эксплантов размером 0,1 -0,2 мм для оздоровления от латентных вирусов;
- регенерация из них растений и микроразмножение;
- тестирование на наличие вирусов;
- культивирование оздоровленных растений при пониженной положительной температуре, при добавлении в питательную среду ростового или осмотического ингибитора, на питательной среде для длительного хранения при пониженной освещенности;
- ежемесячный контроль над ходом хранения растений и по мере необходимости пересадка растений на свежую питательную среду.
Таким образом, исследования, выполненные в лаборатории биотехнологии, показывают большое практическое значение метода клонального микроразмножения для оздоровления растений винограда от вирусной инфекции и производства посадочного материала высших категорий качества, длительного поддержания и сохранения ценных генотипов. Литература - Резолюция II Московского международного конгресса «Биотехнология: состояние и перспективы развития» II Интернет-журнал «Коммерческая биотехнология» [Электронный ресурс]. - Режим доступа: http://www.cbio.ru.
- Абрашева П. Краткие сведения о физиологическом воздействии вирусных болезней на рост и плодоношение виноградной лозы // Физиология винограда и основы его возделывания. - София. - 1983. - С. 227-236.
- Пат. RU 2120739. Способ регенерации меристем / Н.П. Дорошенко, Г.В. Лузгин, А.Ф. Карлов, 1999.
- Дорошенко Н.П., Соколова Г.В. Положительное решение по заявке № 20031276645/12 (029539). Способ регенерации меристем, 2005.
- Пат. РФ 2077192. Способ размножения винограда in vitro / Н.П. Дорошенко, Г.В. Лузгин, А.Ф. Карлов, 1997.
- Пат. RU № 2041609. Способ микроклонального размножения винограда «ин витро» / Б. А. Музыченко, Н.П. Дорошенко, 1995.
- Дорошенко Н.П. Оптимизация условий клонального микроразмножения винограда // Сельскохозяйственная биология. - 1996. - № 5. - С. 28-29.
- Дорошенко Н.П.Оздоровление винограда от хронических болезней методом водной терапии // Виноделие и виноградарство. - 2004. - № 6. - С. 24-27.
9. Соболев А.А. Обоснование приемов световой биотехнологии при клональном микроразмножении винограда // Автореф. дис. ... канд. биол. наук. - Краснодар, 2004. - 25 с. - Соболев А.А., Дорошенко Н.П. Световая биотехнология в культуре изолированных тканей винограда // Виноделие и виноградарство. - 2004. - № 6. - С. 27-30.
- Соболев А.А. Роль светового фактора при культивировании винограда in vitro / Адаптивное ведение виноградарства (селекция, питомниководство, технологии возделывания, виноделие). - Новочеркасск, 2004. - С. 107-114.
- Пат. SU 1792269. Способ адаптации растений к нестерильным условиям / Н.П. Дорошенко, И.А. Кострикин, В.П. Ячменева, 1999.
- Дорошенко Н.П., Пойманов В.Е. Создание сортовых маточников интенсивного типа в Ростовской области // Садоводство и виноградарство. - 1991. - №5.-С. 14-16.
- Пат. RU 2110172. Способ длительного сохранения in vitro растений винограда /Н.П. Дорошенко, Б.А. Музыченко, 1998.
- Хранение коллекций винограда при пониженной температуре / Н.П. Дорошенко, М.А. Хохлова, О.Н. Высоцкая, А.С. Попов, О.Ю. Баскакова // Виноград и вино России. - 1994. -№ 3. - С. 24-27.
По материалам конференции: Современные достижения биотехнологии в виноградарстве и других отраслях сельского хозяйства, Новочеркасск, 29-30 июня 2005 г. / ГНУ ВНИИВиВ им. Я.И. Потапенко.
Источник:http://vinograd.info/stati/stati/biotehnologicheskie-metody-formirovaniya-banka-ozdorovlennyh-rasteniy-i-sohraneniya-genofonda-vinograda-in-vitro.html
|


